Semelhança atômica é uma propriedade ou característica obtida a partir de um estudo comparativo realizado entre os átomos de elementos químicos iguais ou diferentes, no qual avaliamos as igualdades e as diferenças apresentadas por eles, principalmente no que tange aos seguintes critérios:
- Número atômico (Z);
- Numero de massa (A);
- Número de prótons (p);
- Número de elétrons (e);
- Número de nêutrons (n).
Assim, conhecendo a quantidade de partículas (prótons, nêutrons e elétrons) ou os códigos (número atômico e número de massa) durante a comparação entre dois ou mais átomos, podemos classificá-los.
Segundo a propriedade da semelhança atômica, os átomos podem ser classificados em isótopos, isóbaros, isótonos ou isoeletrônicos, como podemos observar em cada caso abaixo:
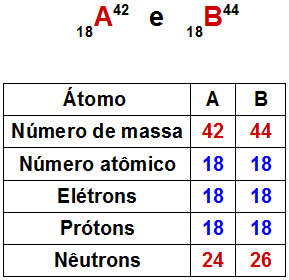
Semelhança atômica na qual os átomos apresentam o mesmo número de prótons (p) ou número atômico (Z), porém devem apresentar diferentes números de massa e de nêutrons. Exemplo de átomos classificados como isótopos:
Tabela com os componentes dos átomos isótopos.
Obs.: Em situações em que os átomos isótopos não sejam íons, o número de elétrons será sempre igual ao número de prótons e, consequentemente, ao número atômico.
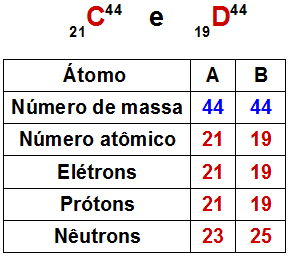
Isóbaros
Semelhança atômica na qual os átomos apresentam o mesmo número de massa (A), mas devem apresentar diferentes números atômicos (Z), de prótons, de elétrons e de nêutrons. Exemplo de átomos classificados como isóbaros:
Tabela com os componentes dos átomos isóbaros.
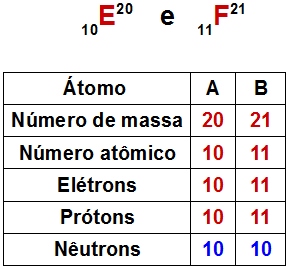
Isótonos
Semelhança atômica na qual os átomos apresentam o mesmo número de nêutrons (n), porém devem apresentar diferentes números de massa (A), atômico (Z), de prótons (p) e de elétrons (e). Exemplo de átomos classificados como isótonos:
Tabela com os componentes dos átomos isótonos.
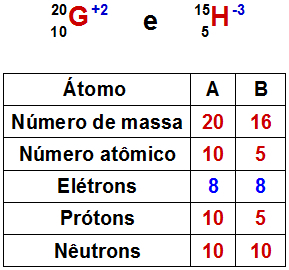
Isoeletrônicos
Semelhança atômica na qual os átomos apresentam o mesmo número de elétrons e podem apresentar ainda um ou mais outros itens iguais, como:
- Número de massa (A);
- Número de nêutrons (n);
- Número de prótons (p);
- Número atômico (Z).
Tabela com os componentes dos átomos isoeletrônicos.
O átomo G apresenta oito elétrons porque seu número atômico é igual a 10, e ele é um cátion bivalente, ou seja, o número de elétrons é duas unidades menor que o número atômico. O mesmo ocorre (oito elétrons) com o átomos H, porque seu número atômico é igual a 5, e ele é um ânion trivalente, ou seja, seu número de elétrons é três unidades maior que o número atômico .
Obs.: Como o número de nêutrons nesses dois átomos também é igual, além de isoeletrônicos, eles devem ser classificados como isótonos.
Texto retirado do site: Manual da química.
Comentários